コロナ軽症者の治療薬「モルヌピラビル(販売名ラゲブリオ)」は日本で2021年の12月24日に特例承認されました。
ところが、この承認時の議事録を読むと「モルヌピラビルは効果がないのでは?」「副作用が日本人では多いのでは?」など有効性や安全性に関して反対意見も相次いでおり、特に気になった発言をまとめました。(議事録のすべては厚労省のこちらに記載)
長めの記事なので、気になるところから見ていってください。時間がない方は「日本人はこの手の薬に弱いのではないか」だけでも読んでみてください。
もくじ
モルヌピラビルの承認議会で利益相反が5名
議事録の内容に入る前に、どうしてもお伝えしたいことがあります。それはモルヌピラビルを承認するかどうかの議会において、参加者17名のうち5名に利益相反の医師がいたことです。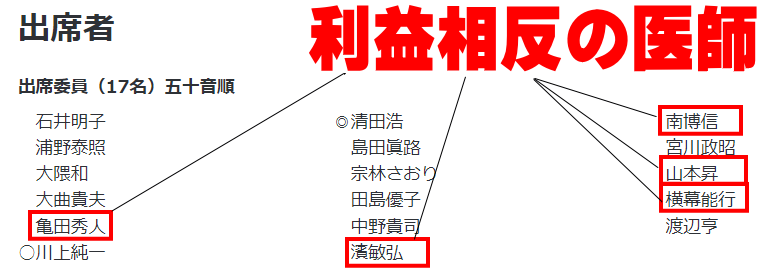
もちろん公式資料にもそれは掲載されていて、この5人は議決には参加していません。
ですが、議事録を読む限り議論には参加しているのです。HIV専門の横幕先生は有効性についてかなり突っ込んだ質問をしておりモルヌピラビルを贔屓する発言があったわけではありませんが、こういう事態は果たして公平なのかという疑念はつきまといます。薬害オンブズパーソンでも利益相反については問題視していました。
では、次に議事録の内容を抜粋していきます。グレーの四角枠で囲っている部分が、議事録の内容抜粋です。(太線や下線、大文字などはサイト管理人によるものです。順番が前後する場合もあるのでご了承ください。)
島田眞路先生(山梨大学学長)の発言
モルヌピラビルの承認前の議会で終始一貫して報道のおかしさ、有効性への疑問と危険性を訴え、反対票を投じた先生です。おそらくですが、山梨大学の学長であり、コロナに関しての書籍「コロナ禍で暴かれた日本医療の盲点/島田眞路/荒神裕之」も出版されています。

日本で特例承認される前からマスコミが騒ぐのはおかしい
まず、承認前からマスコミが嬉々として報じていることへの不満を述べています。
これは1点、指摘しておきたいと思います。本来、この会議で決まった上でという話だと私は思っているのです。
フランスでは購入を見送った
英国で認められたと今、言われましたし、同じようにロイターでは、アメリカでも認められたという話があるのですけれども、フランスで購入中止という大きな出来事が起こっているということは考慮に入れなければいけないのではないかと私は思います。
ロイターの報道はおそらくこちらだと思います→「フランスがメルクのコロナ飲み薬発注取り消し、期待外れの試験効果で」
人数が倍になると効果はほぼない
特例承認のために提出された資料には治験結果が記載されていますが、これに「?」がつく結果となっています。治験参加人数が750名だと効果ありなのに、倍の1500人になるとほんの少しの効果になってしまったことについての発言です。
有意差は0.0218なのでないとは言えませんけれども、先ほどのもう少し大きかった有意差、0.0012に比べると有意差が減ってしまって、追加になった症例数を見てみますと、プラセボが322分の15で4.7%、本薬群は324分の20で6.1%なのです。
つまり、本薬群の方がプラセボ群よりも成績が悪いということです。
表12と表15は承認申請資料の11と15ページに記載されている以下の表です。

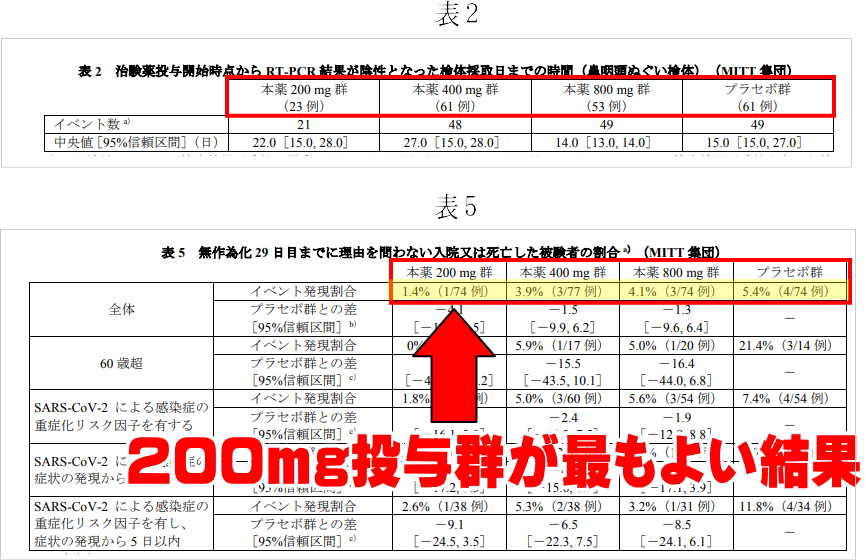
投与量は200mgが一番いいのに、800mg飲むことになっている
次がモルヌピラビルの投与量の話です。現在の処方量は1回で800mg(これを1日2回×5日間)ですが、治験では200mg,400mg,800mg,プラセボで比較した結果200mgで一番よい結果となっています。だったら承認後だって200mg投与でいいよね、という話になるはずが実際は800mg投与。これでは治験の信用性が乏しいといわれてもしかたありません。
抗体がある人に投与しても効いてない
次が、コロナの抗体をすでに持っている人に投与した場合についての発言です。

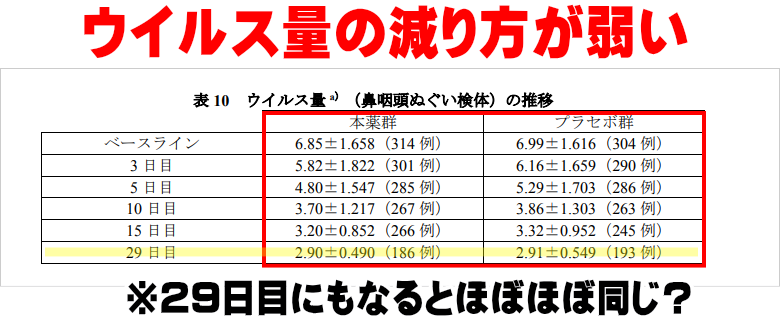
このようなことを全部勘案しますと、大曲先生も先ほど効果が弱いとおっしゃいましたけれども、私はかなり弱いような気がします。
コロナに感染しづらい日本人に効かない可能性
次が、人種間におけるコロナ罹患率の違いから、モルヌピラビルがアジア人には効かないのではないかという発言です。
日本人とかアジア人では、そういうエスニックなことは全く関係がないというお話もありますけれども、SARS-CoV-2感染症そのものはエスニックはものすごく関係があります。アジア人ではSARS-CoV-2に非常にかかりにくいのです。何らかの寄与があって、最近話もありましたが、そういう特性があるので、当然そういうものが出てくるわけです。ある程度抗体があると効きにくいということがあると疑われるということはあるのではないかということです。
この部分を読んで驚いたのは、審議会に参加するような医師たちでも、コロナ感染に人種による差があると思ってない人がいそうだ、ということです。コロナが流行した2020年の夏頃にはすでに「日本人やアジア人はコロナ感染しづらい」という論調があったにも関わらず、2021年の12月になってもまだその知識を持ち合わせていない人たちがモルヌピラビルの承認申請に関わっている・・・島田先生のこの発言が珍しいかのようなそんな状況にものすごくショックを受けました。
ちょっとあまりに審査委員の医師たちは勉強不足すぎやしませんかね?それとも知ってて黙ってるの?知ってて何も発言せず島田先生だけに言わせてるの?知ってるのに特例承認に賛成したの?いずれにせよ、こんなメンバーが賛成して特例承認となり、結果副作用で30人が亡くなり、374人にが重篤で元の生活に戻れていないことになったのです。これはやはり「起こるべくして起きた」人災ではないのかと思うのですが、どうでしょうか。
日本人はこの手の薬に弱いのではないか
ここからはかなり踏み込んだ内容となっていて、それ言っちゃっていいの?というぐらい勇気ある発言になっています。日本人だからこそ、ここはしっかり読んでください。
それと同時に副作用の点ですけれども、先ほどちゃんと読まれなかったのですが、例えば21分の17ページの下3分の1、日本人における安全性の5行目に「本薬800mg群8/15」、これは日本人で800mg投与すると15分の8で副作用が出て、中毒性皮疹が3例、これはその下の(注)35番をみますと2例は経口ステロイド薬を使用しており、10~12日後、治癒となっており軽症との記載はあるが、それほど軽症とは判断できません。
承認審査資料p17

島田眞路先生だけが反対を表明

「反対です」と島田先生がおっしゃったあとのスルー具合が怖くないですか?「わかりました。それでは、お一人反対ということで、ほか、賛成多数で可決させていただきます」と、この勢いで特例承認に至ったのがモルヌピラビルなのです。反対意見についてもう少し議論をしようとか、もう少し大規模な治験を待ちましょうとか、そういった議論が一切されていないのです。はじめから特例承認ありきの出来レースだったのでは?と思えるほどです。
「ちゃんとフォローする」はずができてない
モルヌピラビルの承認審査議会においては、医薬品審査管理課長なる人が、有効性と安全性についても議論はあるけど、ちゃんとフォローするよう徹底します、的なことを言っています。
定期的なフォローアップがしっかりできる医療機関で投与されているはずが、なぜこんなに副作用が出て、重篤もいれば死亡もいるという事態になるのでしょうか?入院するほどでもない軽症患者に対して、本当にフォローアップできていたのでしょうか?フォローアップができていなければそれは当然問題です。さらにいえば、フォローアップできていたのにこの副作用のオンパレードであれば、それはそれで医薬品としてかなりの問題があると言わざるを得ません。
いいですか?これは重症患者に投与する薬ではありません。抗がん剤でもありません。コロナに感染した軽症者向けの薬なのです。入院するまでもない、オミクロン株になってからは重症化率も下がっている、花粉症とも風邪とも区別がつかない、そんな軽い疾患で飲む薬なのに、どうしてこんなにも副作用が多いのでしょうか。そしてなぜ、有効性もよくわからない上に副作用が多く、日本人には危険かもしれない薬剤が未だに投与されているのでしょうか。
承認議会における医薬品審査管理課長の締めの言葉は非常に責任の重たい言葉となっているのにも関わらず、現状は全くそうなってないという意味で重要と思いますので、長くなりますが貼り付けておきます。
○医薬品審査管理課長 先生方、いろいろと御指摘、御意見をどうもありがとうございます。
本剤につきましては、なかなか情報が少ないという中、分からないことが多い、それから、有効性・安全性についての評価もなかなか難しいというのが今の御議論になっているのだろうと思っております。
一方で、宮川先生もおっしゃいましたとおり、お薬を生かす、育薬をしていくという観点から、仮にお認めいただいた後の使い方をどうするのか、すなわち患者さんをしっかりフォローしていける形にし、さらにはその情報をしっかりと企業の方が収集し、そういった情報も含めてさらに医療機関に的確にフィードバックしていく。
その際には、今回の用法・用量がどうやって決まったのかということも含めフィードバックする。さらには、島田先生が御指摘のような妊婦の問題とかについては当然禁忌になっているわけですから、そういったことについてのフィードバックも的確に、特に市販直後の情報提供をしっかりやっていくというような運用をしっかりしていくことは極めて重要なことかなと思います。
そういったことを徹底できるような手だてとして、この薬剤を仮に御承認いただいた後には、国が買い上げた形で薬剤の供給についてコントロールする形になります。その際に、このお薬を処方できる医療機関について、投与後に定期的なフォローアップがしっかりできる医療機関に本剤を届けるということを私ども行政の方からお願いする。
さらに、企業に対しては、市販直後、一定の期間は、いわゆる全例調査をしっかりやって、その内容を医療機関にフィードバックする。そのことを私どもの方から企業に徹底させていただく。そういったことを私どもの方で提案させていただきたいと思います。
そういったことが整うことによって、オミクロン株に対して、抗ウイルス薬でございますのでvitroのデータではあるかもしれませんけれども、一定の効果が当然期待できる薬剤でもございますので、そういった薬剤について有効性・安全性の観点からお認めいただけるのかどうかということについて、今、私が申し上げたような市販後の条件といいますか、運用上、こういう形にさせていただくことをお約束させていただくということをもって、承認の可否を御判断いただければありがたいと思っております。
以上でございます。
コロナ治療薬の関連記事
・イベルメクチン投与後の死亡例6,うち5例がレムデシビルも投与
■※緊急※ロックフェラーが半年以内に食糧難とか言い出しましたね。
健康維持しつつ身体にいい備蓄についてまとめた記事はこちらです。

